开年喜报 | 徐医附院阿尔茨海默病研究论文荣登中科院一区杂志(IF=9.229)
2022新年伊始,徐州医科大学附属医院神经内科耿德勤教授和高丰雷博士后团队在中科院一区杂志(IF=9.229)ACS Applied Materials & Interfaces上在线发表题为“Gold Nanorods with Spatial Separation of CeO2 Deposition for Plasmonic-Enhanced Antioxidant Stress and Photothermal Therapy of Alzheimer’s Disease”的研究论文,报道了KLVFF@Au-CeO2(K-CAC)纳米药物在改善AD模型小鼠认知功能方面的作用。硕士研究生葛可桢为第一作者,耿德勤教授和高丰雷副教授为通信作者。

耿德勤教授和高丰雷博士团队设计的实验是把一同患有阿尔兹海默症的小老鼠分为两个组,对其中一个组进行干预治疗,最后通过对比两个组的老鼠,完成水迷宫和筑巢的时间长短来评价治疗的方式是否有效。经过长达三年的实验,明显发现,经过治疗的阿尔兹海默症的老鼠通过水迷宫的路线短、时间短,而且筑巢时间也短,筑巢的质量也高。最终验证出,他们对于患有老年痴呆老鼠的干预治疗方式是有效的。因为要收集的数据很多,有老鼠行为观察记录,有分子层面的数据变动,有化学元素跟踪了解……而且一次成功的实验过程不能有一丝差错,还要反复校正。自2018年以来,他们反反复复实验了三年,科研团队开玩笑:“这三年里,看老鼠的时间,比看家人的时间都长。看久了,觉得老鼠都越来越漂亮了!”

纳米CeO2的过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性为其在包括AD在内的神经系统氧化应激疾病中的应用提供了可能性。等离子体光热效应产生的热电子的加入可以将CeO2的光催化活性扩展到近红外区(NIR),显著改善其氧化还原性能。这项工作将CeO2纳米粒子包覆在等离子体金纳米棒的两端,将Aβ靶向抑制多肽KLVFF修饰到金纳米棒的中间表面,将NIR光催化和光热疗法引入到AD的治疗中。同时,空间分离结构提高了催化性能和光热转化效率,体内外多个层面验证了它的生物相容性和治疗效果,并具有改善AD模型小鼠认知功能的作用。
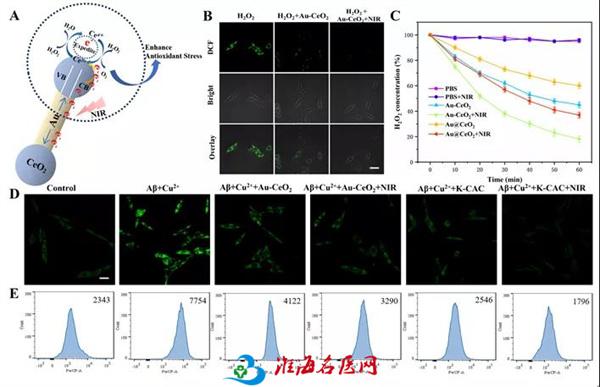
为了验证K-CAC的抗氧化应激作用,研究团队通过ROS特异性荧光探针DCFH-DA分析了过氧化氢的分解水平来评估K-CAC的催化性能。结果表明,NIR激光照射下,等离子体Au NRs产生的热电子注入到Ce3+,从而加速Ce4+向Ce3+的转化,能够提高H2O2的分解效率。进一步的,通过一系列实验验证了K-CAC对Aβ诱导的ROS的清除作用。
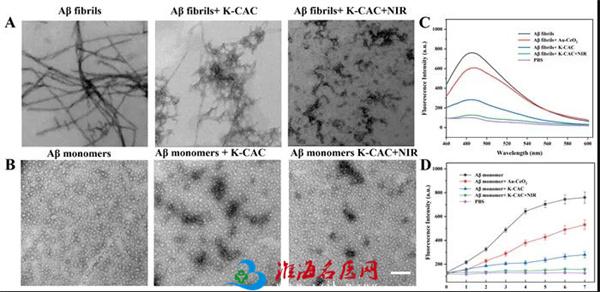
Aβ单体聚集成纤维丝并在神经元外聚积,干扰突触功能,其寡聚体形式具有很强的细胞毒性。为了证实K-CAC对Aβ的抑制作用,通过透射电子显微镜研究了K-CAC对 Aβ聚集过程的影响。结果表明,NIR激光处理条件下,K-CAC对Aβ单体的聚集过程具有明显的抑制,并对Aβ预制纤维具有破坏作用。
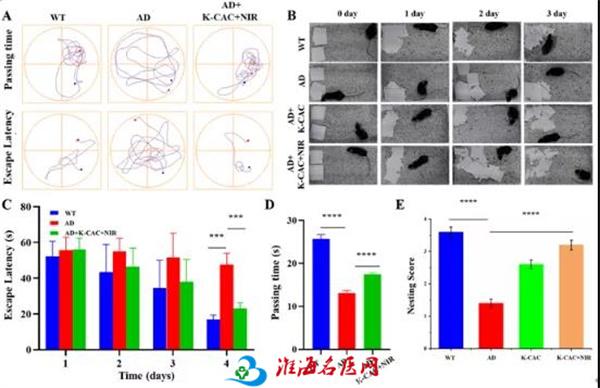
采用Morris水迷宫试验和筑巢试验评价了K-CAC对改善AD模型小鼠认知功能的作用。结果显示AD小鼠表现出明显的学习缺陷,而K-CAC治疗组找到平台的时间更短,在目标象限游泳的时间更长,这表明K-CAC联合光热治疗可以改善AD小鼠的记忆功能。通过筑巢试验进一步验证了K-CAC的筑巢能力优于AD小鼠组。这些结果表明,K-CAC明显改善了AD小鼠的认知功能。
总的来说,研究团队设计的K-CAC纳米复合物可通过多个作用靶点改善阿尔茨海默症的认知功能,有望用于阿尔茨海默症的多模式治疗。大量实验结果证明,K-CAC通过抑制Aβ单体聚集,分解Aβ纤维,清除ROS来改善阿尔茨海默症小鼠的认知功能。此外,该纳米药物具有较高的稳定性和良好的生物相容性,因此高效光催化和多靶点协同效应的引入为纳米技术在阿尔茨海默症治疗中的转化应用提供了新的思路。


扫一扫,分享本页





